Implantación embrionaria

Dr. José Giangreco Ayub
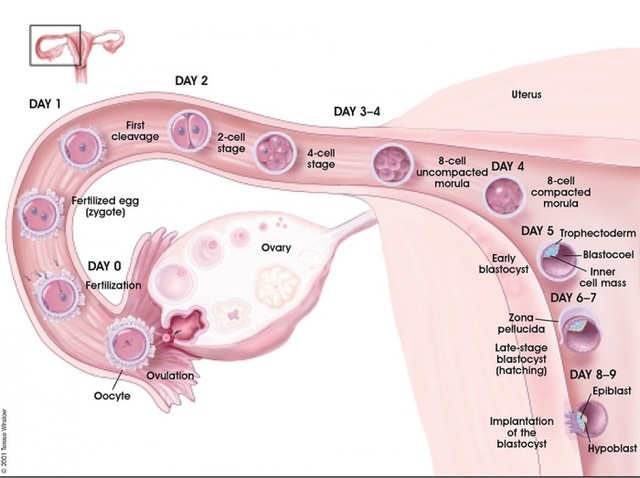
La implantación embrionaria es el proceso mediante el cual el embrión en estadio de blastocisto se fija al endometrio materno para continuar su desarrollo intrauterino.
La implantación en la especie humana es un proceso que podemos catalogar de “poco eficaz”, ya que sólo el 30% de los embriones consiguen implantarse.
La implantación embrionaria humana tiene lugar en un momento específico dentro del ciclo menstrual, denominado ventana de implantación, el cual comprende entre el 6o-10o días tras la ovulación, y debe coincidir con el embrión en estadio de blastocisto.
La implantación consta de cuatro fases distintas, relacionadas y consecutivas:
1. Aposición: durante esta fase el blastocisto humano busca su lugar de implantación, orientándose de forma específica con su masa celular interna en el polo por el que el trofoectodermo se va a adherir al epitelio endometrial superficial.
2. Adhesión: se produce el contacto directo entre el epitelio endometrial y el trofoectodermo del blastocisto, con lo que el embrión queda inicialmente pegado al útero. Ambas fases se producen entre el sexto y séptimo días después de la fertilización.
3. Rotura de la barrera epitelial (epitelio y membrana basal). Esta fase es fundamental para que el blastocisto pueda progresar hacia el estroma endometrial.
4. Invasión: el trofoblasto embrionario penetra en el estroma e invade los vasos endometriales-miometriales reemplazando a las células endoteliales.
Todo este proceso está regulado y condicionado por una serie de factores, tanto a nivel endometrial como embrionario, que pueden ser sistémicos y/o locales, y en su mayoría desconocidos.
FACTORES CONOCIDOS QUE DISMINUYEN LA IMPLANTACIÓN EMBRIONARIA
• Edad Avanzada (>38 años).
• Baja Respuesta.
• Estimulación Ovárica Controlada: a mayor respuesta, menor tasa de implantación.
• Endometriosis.
• Hidrosalpinx no tratados.
• Transferencia de embriones de mala calidad.
• Transferencias embrionarias dificultosas, con sangrados y excesiva manipulación uterina.
• Presencia de patologías que alteran la cavidad uterina: Miomas submucosos e intramurales que afecten la cavidad uterina, pólipos endometriales, malformaciones uterinas, sinequias endometriales, endometritis, etc.
• Desarrollo endometrial inadecuado (<7mm)
• Luteinizacion Prematura: valores de progesterona superior a 1.5 ng/ml el dia de la HCG.
Por lo citado anteriormente es fundamental la evaluación de todos los factores conocidos con un Programa Diagnóstico de Infertilidad dirigido a corregir las patologias orgánicas que pudieran afectar el proceso natural de la implantación embrionaria, antes de iniciar cualquier Técnica de Reproducción Asistida.
FALLO DE IMPLANTACIÓN
Es difícil establecer una definición clara de Fallo de Implantación (FI). Tradicionalmente se han aceptado los siguientes conceptos:
• No consecución de embarazo tras la transferencia de más de diez embriones de buena calidad.
• No conseguir gestación tras dos transferencias embrionarias de buena calidad en menores de 37 años, o tras tres transferencias en pacientes de 37 años o más.
La Sociedad Española de Fertilidad (SEF), en el año 2007, propone la siguiente definición: “Se considera fallo de implantación aquella situación en la que no hemos conseguido una gestación tras transferir, en al menos 3 ocasiones, 3 embriones de buena calidad en un ciclo de FIV o de donación de ovocitos”.
En primer lugar el diagnóstico en la gran mayoría de ocasiones es por exclusión, es decir, sabemos lo que no es un fallo de implantación. Estarán en fallo de implantación aquellas pacientes que tras la realización de 2 o 3 transferencias de embriones de buena calidad (con al menos 6 embriones o más) no consigan gestación siempre que todos los factores que intervienen en el proceso de consecución de embarazo se encuentren dentro de la normalidad. Estos factores son:
• Factor Uterino-tubárico-peritoneal
• Gametos
• Técnica de transferencia embrionaria
Siempre dentro del marco de mujeres fuera del grupo de edad avanzada, que podemos considerar mayores de 38 años.
Y desde que contamos con altas tasas de supervivencia tras vitrificación de embriones y buenas tasas de gestación en transferencias de embriones congelados, deben tenerse en cuenta este tipo de ciclos en el cómputo global de embriones que han sido transferidos en mayor o menor medida.
HERRAMIENTAS ACTUALES ANTE UN FALLO DE IMPLANTACIÓN
En la actualidad contamos con las siguientes herramientas ante la presencia de un fallo de implantación:
• Evaluación de la receptividad endometrial.
• Cultivo Prolongado.
• Estudio Genetico Preimplantacional.
• Cariotipo de la pareja.
• Evaluación del Factor Inmunohematológico.
• Assisted Haching y Aspiración de Fragmentos.
• Embryoscope.
1. EVALUACIÓN DE LA RECEPTIVIDAD ENDOMETRIAL:
El estudio del endometrio es uno de los campos que en reproducción siguen suponiendo un reto para clínicos y personal de laboratorio. Su crecimiento y desarrollo se regula por mecanismos complejos, en parte inducidos por las hormonas esteroideas y con gran dificultad para ser evaluados.
Se han postulado diversos mecanismos responsables de la disregulación en la receptividad endometrial, así como la posibilidad de establecer su diagnóstico mediante diversas técnicas: marcadores histológicos, bioquímicos, valoración mediante eco-doppler de los flujos arteriales a nivel endometrial, factores inmunológicos y paracrinos. Ninguno de ellos ha demostrado eficacia y no ofrece ventajas para el manejo clínico del fallo de implantación.
En la actualidad, los estudios se centran en intentar describir cual sería el patrón de expresión génica que se corresponde con un estado de receptividad endometrial adecuada, pues se sabe que los cambios morfológicos y bioquímicos del endometrio se deben a la activación o la represión de una red de genes influenciados por el papel que juegan las hormonas esteroideas y posiblemente otros factores autocrinos y paracrinos.
La identificación del patrón génico de receptividad endometrial gracias a la tecnología de microArrays es objeto de estudio por diversos grupos de trabajo. Los esfuerzos se centran en el desarrollo de un mapa genómico del endometrio receptivo y el no receptivo que sea identificable y reproducible, igual que se ensayan diversos tratamientos que pudieran mejorar el grado de receptividad endometrial. Como consecuencia de estas investigaciones nace una herramienta genómica denominada Endometrial Receptivity Array (ERA), con la tecnología de microArrays y un algoritmo de predicción bioinformático se crea para datar la ventana de implantación estudiando biopsias de endometrio. Esta herramienta ha probado ser más consistente en el diagnóstico que los criterios histológicos de Noyes, y en su evolución nos lleva a un nuevo concepto que es la ventana de implantación personalizada, es decir, la personalización de la transferencia embrionaria identificando individualmente cada caso.
Por otro lado se han ideado pautas de tratamientos médicos para mejorar aquellos endometrios considerados como insuficientes (grosor inadecuado) o para aumentar la vascularización de los mismos, que contienen pentoxifilina-vitamina E, sildenafilo, glucocorticoides, altas dosis de estrógenos y AAS a baja dosis con resultados heterogéneos y no concluyentes.
Aunque controvertido, el uso de la inmunoterapia para mejorar la receptividad endometrial también ha obtenido resultados positivos en algunos estudios. El tratamiento con inmunoglobulinas iv que llevaron a cabo en el estudio de Elram et al. en 2005 consiguió mejorar las tasas de embarazo en aquellas pacientes tratadas con esta terapia. En otro estudio español realizado por el Departamento de Inmunología del Hospital Gregorio Marañon de Madrid, encuentran mejores tasas de gestación y recién nacido vivo en el grupo de pacientes con fallo de implantación y factores inmunológicos alterados como Natural Killer y/o Natural Killer like que fueron tratadas con Inmunoglobulinas Intravenosas. Actualmente, su uso no está generalizado, debido a la complejidad del tratamiento y a no estar exentas de efectos secundarios, se precisan mayores estudios prospectivos en esta línea para verificar sus potenciales beneficios.
En los últimos años estamos asistiendo a un aumento del procedimiento denominado “endometrial injury”, son biopsias o microlegrados realizados en determinado momento del ciclo previo al de la implantación. El posible daño celular, parece generar una respuesta inflamatoria a nivel endometrial, que parece mejorar las tasas de implantación y embarazo en aquellos grupos que lo llevan a cabo .
2. CULTIVO PROLONGADO
La realización de cultivo largo puede suponer una alternativa al PGS en pacientes con fallo de implantación. Transferir en estadio de blastocisto permite que exista una mejor sincronización entre el embrión y el endometrio. Es el momento concreto en el cual el blastocisto rompe la zona pelúcida, y el endometrio está preparado para que el embrión pueda adherirse, invadirlo y seguir el resto de fases que lo encaminen a conseguir la gestación.
Si se comparan las tasas de implantación de embriones en estadio de blastocisto con la de embriones en día 3, se obtienen mejores resultados en el cultivo largo, en estudios realizados en pacientes de buen pronóstico.
La realización de cultivo largo no es equiparable al PGS, ni lo sustituye. Aunque se sabe que los embriones con aneuploidías tienen mayor posibilidad de bloqueo durante la activación del genoma, no todas las anomalías cromosómicas son incompatibles con la formación del blastocisto. Por lo tanto, la realización de transferencias de blastocistos no nos asegura la normalidad cromosómica de estos embriones, no es una herramienta para seleccionar embriones cromosómicamente normales.
En estudios realizados en pacientes menores de 36 años, se obtuvieron mejores tasas de gestación con transferencia de embrión único en estadio de blastocisto, que en estadio día 3.
Por ello, podemos afirmar que en casos seleccionados, podemos mejorar las tasas de gestación con el cultivo largo, pero para ello se hace necesario tener un buen número de embriones de buena calidad en día 3, que nos permita pensar que alguno de ellos podrá llegar a estadio de blastocisto y ser transferido.
3. ESTUDIO GENÉTICO PREIMPLANTACIONAL
El diagnóstico genético preimplantacional (PGD) se desarrolló inicialmente como una opción para parejas portadoras de enfermedades genéticas o enfermedades cromosómicas ligadas al X de tener hijos sanos. Desde los primeros nacimientos de niños con estas técnicas hace 20 años, el rango de indicaciones ha ido en aumento, incluyéndose otras enfermedades monogénicas o anomalías estructurales de los cromosomas.
El screening genético preimplantacional (PGS), por otro lado, consiste en la búsqueda de anomalías cromosómicas numéricas en parejas con cariotipos normales que presentan problemas de fertilidad. La base para utilizar estas técnicas viene del elevado porcentaje de anomalías cromosómicas observadas en abortos esporádicos y de repetición. Según esto, la selección de embriones euploides para los cromosomas analizados (aquellos más frecuentemente encontrados en abortos) incrementaría el éxito en tratamientos de reproducción, además de reducir la tasa de abortos.
En los últimos años, el desarrollo de la técnica de Arrays permite tener la información de todos los cromosomas del embrión en los ciclos de Diagnóstico Genético Preimplantacional. Sin duda, es un importante avance con respecto a la tecnología anterior, y posiblemente se puedan beneficiar de ella el subgrupo de pacientes con fallo de implantación, debido a las ventajas que aporta en la selección embrionaria. Aún son necesarios estudios prospectivos, randomizados que aporten evidencia clínica a este procedimiento. En una revisión de los resultados publicados en la literatura y datos propios no publicados de Rubio et al en 2013, encuentran que el análisis con arrays-CGH de los 24 cromosomas incrementa la tasa de gestación e implantación.
Posiblemente, en el futuro podamos detectar la presencia de otros marcadores, ya sean genéticos, cromosómicos o bioquímicos, en los embriones, que nos permitan seleccionarlos de forma más precisa, sobre todo sin la necesidad de utilizar métodos invasivos. En la actualidad, nuestro criterio debe ser exponer estos posibles beneficios en cuanto al diagnóstico a los pacientes.
4. CARIOTIPO DE AMBOS MIEMBROS DE LA PAREJA
Por otro lado sabemos que la embriogénesis puede verse alterada en caso de alteraciones cromosómicas paternas. Es indicación realizar el cariotipo a ambos miembros de la pareja en casos de fallo de implantación. Algo más discutido sería la realización de esta prueba como estudio de rutina, o de primera línea, debido a un factor de coste-eficacia, no así en casos de fallo de implantación, donde si es totalmente recomendable.
5. ESTUDIO DEL FACTOR INMUNOHEMATOLÓGICO
En trabajos recientes se ha demostrado una mayor prevalencia de trombofilias en pacientes con fallo de implantación, de forma similar a lo que ocurre con las pacientes con aborto de repetición.
Por lo tanto, la realización del estudio de trombofilias heredadas o adquiridas se plantea como una opción que podemos ofrecer, y en caso de encontrarnos con alguna alteración se indicaría el tratamiento adecuado, habitualmente con diversas pautas de Heparina de Bajo Peso Molecular (HBPM). Si bien, no en todos los casos de trombofilias estos tratamientos han demostrado beneficio.
La batería que debemos solicitar es la siguiente:
• Mutación de factor V Leiden.
• Mutación C677T homocigota de la Metilen Tetrahidrofolato reductasa (MTHFR)
• Mutación G20210A gen protrombina.
• Déficit de Antitrombina III.
• Déficit de Proteína C funcional.
• Déficit de proteína S libre.
• Resistencia a Proteína C activada.
• Anticoagulante lúpico.
• Anticuerpos anticardiolipina Ig G e Ig M.
• Homocisteinemia
6. ASPIRACIÓN DE FRAGMENTOS Y ASSISTED HATCHING
Podemos encontrarnos ante el caso de fallo de implantación en parejas con embriones con características que no sean las adecuadas. Si los embriones presentan una morfología alterada, esto podría justificar el bloqueo y la no implantación.
En estos casos concretos, podemos ofrecer la posibilidad de realizar técnicas como son el hatching asistido y aspiración de fragmentos, pues parecen mejorar la tasa de gestación en este tipo de pacientes en manos experimentadas. Si bien no hay estudios randomizados bien diseñados que demuestren su utilidad.
El hatching asistido consiste en realizar en el laboratorio una apertura en el embrión para facilitar la eclosión, que ocurre de forma fisiológica en estadio de blastocisto previo a la implantación.
La aspiración de fragmentos celulares consiste en aspirar blastomeras degeneradas que podrían dificultar las señales intercelulares que favorecen la división embrionaria.
Pueden realizarse los dos procedimientos o sólo uno de ellos. Si tras intentar mejorar la calidad embrionaria con estos procesos se repite el fallo de implantación, debemos aconsejar a la pareja la reevaluación de los gametos, y plantearles el cambio de alguno de ellos antes de iniciar un nuevo ciclo.
Es una tarea difícil, y no exenta de controversia, pues a veces no tenemos evidencia de cuál de los dos gametos debemos cambiar. Si está claro que estamos ante un caso de mala calidad ovocitaria, plantearemos donación de ovocitos.
7. EMBRYOSCOPE
El Embryoscope es un novedoso sistema de monitorización de embriones cuya tecnología permite observar la evolución del embrión en tiempo real desde el momento de la fecundación hasta la transferencia embrionaria. Aporta información sobre la división celular y el consumo de oxígeno sin tener que sacarlo del incubador, realizando fotografías cada 10 o 15 minutos. El uso de este tipo de sistemas de monitorización embrionaria parece aportar ventajas en cuanto a la selección embrionaria y puede ser una alternativa no invasiva que ofrecer a pacientes con fallo de implantación. Aún son necesarios estudios prospectivos, randomizados que demuestren su seguridad y eficacia para aplicarlos sistemáticamente a la práctica clínica diaria.
CONCLUSIONES
A pesar de todo lo expuesto, el fallo de implantación sigue constituyendo un reto para el clínico, ya que desde que se iniciaron los primeros tratamientos de reproducción asistida hasta nuestros días, son muchos los conocimientos que se han ido ampliando y mejorando en diversos campos. Se han optimizado los fármacos utilizados para la estimulación ovárica, así como las necesidades nutricionales que intervienen en los procedimientos de gametogénesis y desarrollo embrionario, que tienen lugar dentro del laboratorio. Sin embargo, en el campo de la implantación embrionaria, no se ha conseguido una ampliación de conocimiento suficiente que nos permita incrementar nuestros resultados, cuando lo que falla es, precisamente, este eslabón clave en la cadena de acontecimientos.
